Transpozony, znane jako skaczące geny, potrafią "wyciąć się" z DNA, a potem wkleić w jego inne, często precyzyjnie wybrane miejsce. Naukowcy widzą w nich przyszłość edycji genomów. Polscy badacze dokonali ostatnio trudnego zadania: pokazali, jak wygląda kluczowe białko związane z działaniem transpozonu, kiedy ten "szykuje się do skoku”.
"Nasza praca dokłada kolejną cegiełkę do zrozumienia, jak działa białko, które potrafi wycinać duże fragmenty DNA i wstawiać je w inne miejsce" - podsumowuje w rozmowie z PAP prof. Marcin Nowotny z warszawskiego MIBMiK. Zespół prof. Nowotnego - wspólnie z Josephem Petersem z Cornell University (USA) - opublikował wyniki swoich badań w prestiżowym "Molecular Cell".
Transpozony to pasożyty w genomie. Niektóre z nich nie tylko się przemieszczają, ale wykorzystują też maszynerię komórkową organizmów, aby się namnażać - tłumaczy prof. Nowotny. "Nawet 50 proc. ludzkiego genomu i 70 proc. genomu niektórych roślin może pochodzić właśnie od transpozonów" - mówi (choć w większości transpozony te nie są tam aktywne). Od transpozonów pochodzą również niektóre wirusy, w tym wirus HIV. Istnieją także transpozony, za sprawą których bakterie stają się oporne na działanie antybiotyków. To daje mały wgląd w to, jak powszechne są w naturze „skaczące geny”.
Prof. Nowotny zaznacza, że choć transpozony potocznie nazywane są skaczącymi genami, to - precyzyjnie mówiąc - powinno się o nich mówić jako o skaczącym DNA (bo transpozon nie jest genem, ale może geny zawierać).
Transpozony odniosły niezwykły ewolucyjny sukces i są bardzo zróżnicowane. Niektóre działają przez wycinanie siebie z DNA - i wklejanie się w precyzyjnie wybrane miejsce genomu. To operacja, która przypomina w edytorze tekstu polecenia wytnij i wklej (CTRL+X i CTRL+V). Jeśli naukowcy chcą edytować genom bez żadnych nieprzewidzianych błędów - tak precyzyjnie, jak chcemy edytować tekst - powinni poznać i wykorzystać podobne sztuczki samej natury.
Dlatego marzy się im przygotowanie sztucznego transpozonu, który wklejałby do DNA wybrane geny. Można sobie wyobrazić, że takie narzędzie ratować będzie kiedyś życie i zdrowie osób z chorobami genetycznymi, których DNA koduje wadliwy rodzaj białka. Takie osoby być może mogłyby mieć w ramach terapii dostarczane do organizmu sztuczne transpozony, które w bezpiecznym miejscu wklejałyby się do DNA gospodarza. A wtedy jego organizm mógłby sam produkować sobie lekarstwo - prawidłowe białko niezbędne dla zdrowia.
Jeśli chodzi o możliwości edytowania DNA, głównym narzędziem jest obecnie maszyneria CRISPR-Cas9 (Nobel 2020), czyli genetyczne nożyczki. Mechanizm ten - który naukowcy odkryli podczas badań bakterii - pozwala znajdować w DNA precyzyjnie wybrane miejsce i je przecinać. W miejsce przecięcia mogą wklejać się geny, które są sztucznie dostarczone do komórki. Na razie jednak nikt nie ma gwarancji, że zawsze właśnie tak się stanie, i że w miejscu przecięcia nie będą się tworzyły mutacje. Procedura CRISPR-Cas9 wymaga udoskonalenia. Trzeba więc znaleźć sposób na bardziej precyzyjne wklejenie wybranego genu w miejsce przecięcia i ponowne sklejenie DNA.
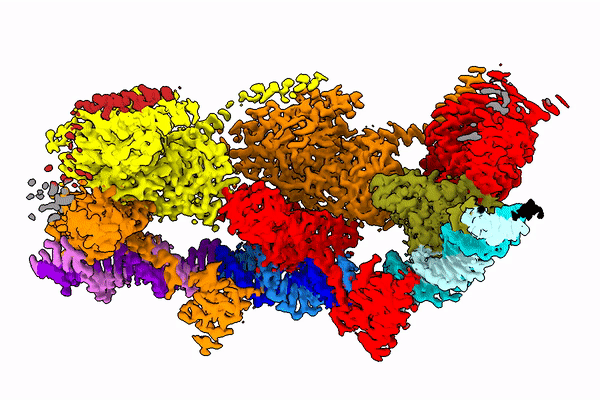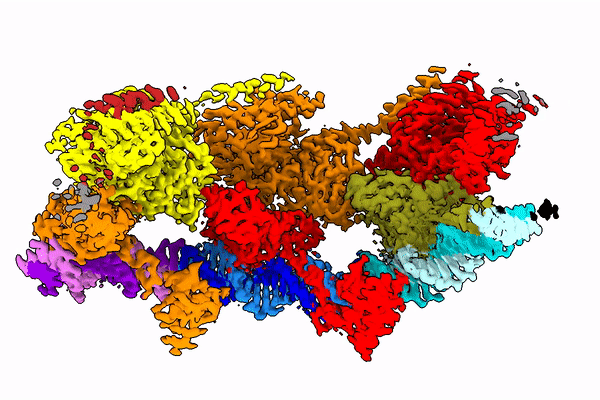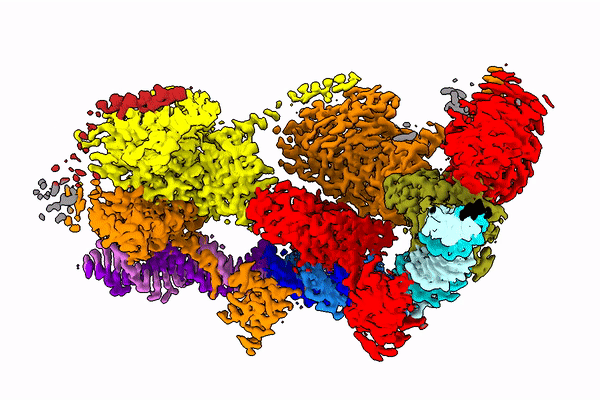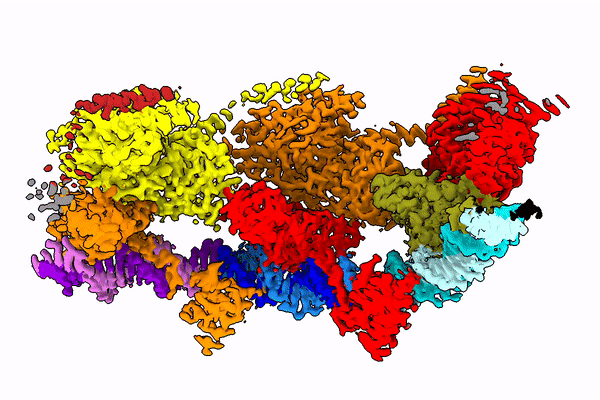
Świętym Graalem na tym polu wydaje się właśnie transpozon Tn7, pochodzący od bakterii. Jego wykorzystanie wydaje się możliwe, bo w niektórych jego wariantach naturalnie zakodowana jest właśnie ta, dobrze już poznana, maszyneria CRISPR-Cas9. Transpozon wykorzystuje ją do wyboru miejsca genomu, w które się wstawi.
Jeden z genów transpozonu Tn7 koduje enzym - transpozazę, której zadaniem jest wycięcie kilkunasty tysięcy nukleotydów (liter kodu genetycznego) transpozonu z jednego miejsca i wklejenie go w inne.
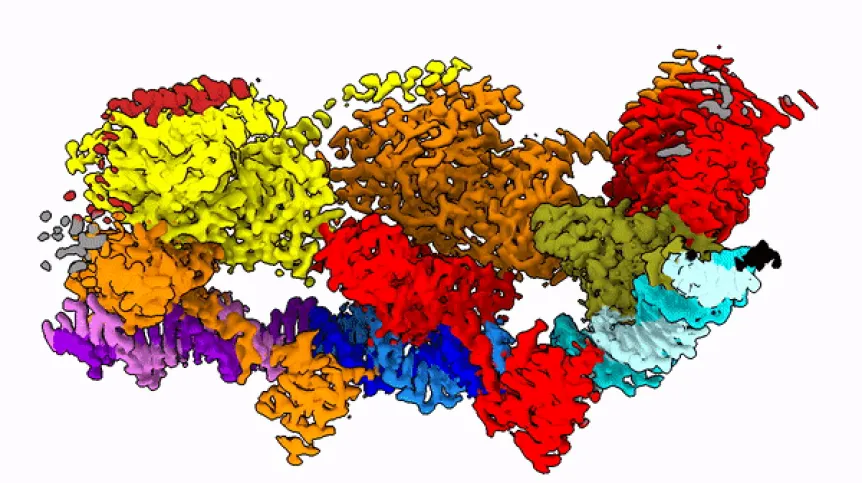
Żeby zrozumieć, jak owo skomplikowane zadanie, jakie wykonuje enzym, jest w ogóle możliwe, naukowcy chcą poznać strukturę transpozazy - a więc jej kształt. Bo to właśnie od tego kształtu zależy to, jak działa ona w komórce. Badanie takich białek to bardzo trudne zadanie, gdyż enzym ten składa się z kilkudziesięciu tysięcy atomów. Jest w dodatku bardzo ruchliwy - jego kształt zmienia się w zależności od fazy operacji, którą wykonuje.
Zespół prof. Nowotnego posłużył się kriomikroskopem elektronowym (Nagroda Nobla 2017), który od kilku lat znajduje się w krakowskim Centrum SOLARIS. Dzięki tej technologii badacze mogą obserwować cienie zamrożonych w ruchu, pojedynczych cząsteczek. I na podstawie tych cieni odtwarzać niezwykle skomplikowaną strukturę 3D badanych molekuł.
A molekuła ta - choć składa się z dziesiątek tysięcy atomów - jest nadal malutka. Gdyby zmienić proporcje różnych obiektów i cząsteczkę tę powiększyć do rozmiarów jabłka - analogicznie powiększony człowiek miałby wysokość 20 tys. km, a więc mógłby owinąć sobą pół Ziemi.
Prof. Nowotny w rozmowie z PAP porównuje badane białko do sznura, na który nanizane są korale. "Korale te tańczą w przestrzeni i układają się zupełnie inaczej w zależności od fazy skoku enzymu z jednego miejsca na drugie" - opisuje naukowiec.
W publikacji z "Molecular Cell" zespół pokazał, jak białko to wygląda w momencie, kiedy mości się na DNA (po rozpoznaniu końcówki tego fragmentu DNA, który ma wyciąć).
Naukowcy z całego świata ścigają się jednak, aby pokazać model białka w innych fazach jego działania. I tak np. zespół z Cornell University przedstawił niedawno kształt tego samego białka w momencie wklejania elementu w inne miejsce.
Badaczom udało się więc "sfotografować" niezwykle interesujące cząsteczki w paru ważnych momentach ich pracy. Przed nimi wciąż jednak sporo wysiłku, aby poznać kształt tego białka w jeszcze innych fazach tej operacji. Bez tego trudno będzie zrozumieć w pełni, jak pracuje ta cząsteczka, i jak związany z nią mechanizm wykorzystać w praktyce.
PAP – Nauka w Polsce, Ludwika Tomala
lt/ zan/
Fundacja PAP zezwala na bezpłatny przedruk artykułów z Serwisu Nauka w Polsce pod warunkiem mailowego poinformowania nas raz w miesiącu o fakcie korzystania z serwisu oraz podania źródła artykułu. W portalach i serwisach internetowych prosimy o zamieszczenie podlinkowanego adresu: Źródło: naukawpolsce.pl, a w czasopismach adnotacji: Źródło: Serwis Nauka w Polsce - naukawpolsce.pl. Powyższe zezwolenie nie dotyczy: informacji z kategorii "Świat" oraz wszelkich fotografii i materiałów wideo.