Naukowcy ustalili, jak uruchamia się toksyczna maszyneria białkowa w przebiegu Zespołu Bartha - genetycznej choroby ujawniającej się u chłopców. Problemy z sercem, mózgiem i mięśniami sprawiają, że większość pacjentów umiera we wczesnym dzieciństwie. Prace 40-osobowej grupy badaczy z udziałem Polki niosą nadzieję na zaprojektowanie leku - poinformował Uniwersytet Mikołaja Kopernika.
Zespół Bartha dotyka chłopców - cierpią oni na poważne problemy m.in. z sercem, mięśniami szkieletowymi, prawidłowym procesem wzrostu i układem nerwowym. Dziewczynki mogą być jedynie bezobjawowymi nosicielkami. Choroba występuje raz na 400 tys. urodzeń i rozwija się głównie w pierwszej dekadzie życia. Charakterystyczne cechy wyglądu dzieci to głęboko osadzone oczy, wydatne policzki, wysokie czoło czy odstające uszy. Schorzenie powoduje też trudności wzrokowo-przestrzenne i matematyczne. Rokowania pacjentów są bardzo złe. Chociaż pierwszy przypadek został opisany w 1983 r. przez zespół holenderskiego uczonego Petera Bartha, do tej pory nie udało się znaleźć skutecznego leku. Terapia chorych polega na leczeniu objawów.
O nadziejach na lek poinformował Uniwersytet Mikołaja Kopernika. Międzynarodowa grupa badawcza z udziałem dr hab. Karoliny Mikulskiej-Rumińskiej z Wydziału Fizyki, Astronomii i Informatyki Stosowanej UMK odkryła mechanizm odpowiedzialny za powstanie i rozwój choroby. Naukowcy wytypowali związek chemiczny, jaki może być wprowadzony do testów klinicznych dla pacjentów z zespołem Bartha.
Niemal 40-osobowa grupa badaczy i badaczek postanowiła przyjrzeć się tematowi kompleksowo. Począwszy od eksperymentów biochemicznych i biofizycznych, poprzez modelowanie komputerowe, a kończąc na testach na zwierzętach oraz badaniach na próbkach z biopsji pacjentów z zespołem Bartha. Prof. Karolina Mikulska-Rumińska była odpowiedzialna za wyjaśnienie mechanizmów molekularnych leżących u podstaw choroby przy użyciu modelowania komputerowego.
"W zespole Bartha mamy do czynienia z mutacją w chromosomie X, a dokładnie w genie TAZ. To gen, który koduje tafazynę, czyli białko, które bierze udział w metabolizmie lipidów, a dokładnie kardiolipin" – wyjaśnia biofizyk. Podkreśla, że kardiolipiny są bardzo ważne - występują w mitochondriach, czyli naszych "fabrykach energii", zasilających wiele procesów w organizmie.
"Jeśli mamy do czynienia z mutacjami w tafazynie, wówczas kardiolipiny nie powstają, a w zamian akumulują się monolizokardilipiny, czyli kardiolipiny bez jednego łańcucha acylowego. I wtedy mamy poważny problem, ponieważ kardiolipiny wpływają na funkcje stu innych białek mitochondrialnych" - tłumaczy prof. Karolina Mikulska-Rumińska. Dodaje, że kardiolipiny tworzone są z monolizokardiolipin m.in. przy pomocy tafazyny. W zespole Bartha dochodzi do nagromadzenia monolizokardiolipin i deficytu kardiolipin.
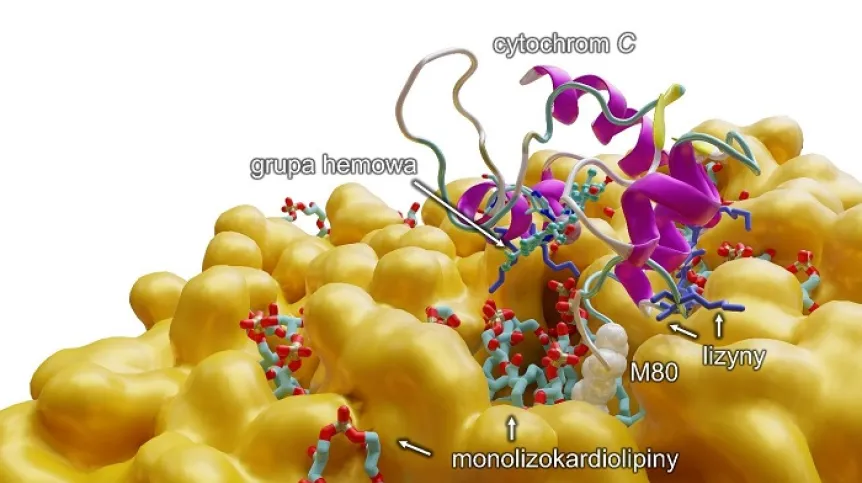
"Udało nam się ustalić, że monolizokardiolipiny, czyli ta uboższa wersja kardiolipin, łączą się z cytochromem c. To bardzo ważne białko, odpowiedzialne m.in. za oddychanie komórkowe, a także biorące udział w programowanej śmierci komórki. Odkryliśmy, że monolizokardiolipina, łącząc się z cytochromem c, zmienia jego funkcje, (...) kompleks zaczyna działać jak maszyneria tworząca "toksyczne fosfolipidy", które zaczynają wpływać negatywnie właśnie na mięśnie szkieletowe, serce czy mózg. Udowodniliśmy więc, że to ten kompleks - monolizokardiolipiny z cytochromem c jest podstawą, początkiem zespołu Bartha" - mówi profesor UMK.
Zespół wskazał również konkretny związek chemiczny, który blokuje kompleks cytochromu c z monolizokardiolipiną. Prof. Mikulska-Rumińska na modelu komputerowym pokazała, w jaki sposób ten proces przebiega. Badaczka ocenia, że pozwoliło to lepiej zrozumieć podstawy molekularne badanego układu, co jest niezbędne do zaprojektowania efektywnego leku.
Artykuł prezentujący wyniki badań "Anomalous peroxidase activity of cytochrome c is the primary pathogenic target in Barth syndrome" ukazał się w "Nature Metabolism".
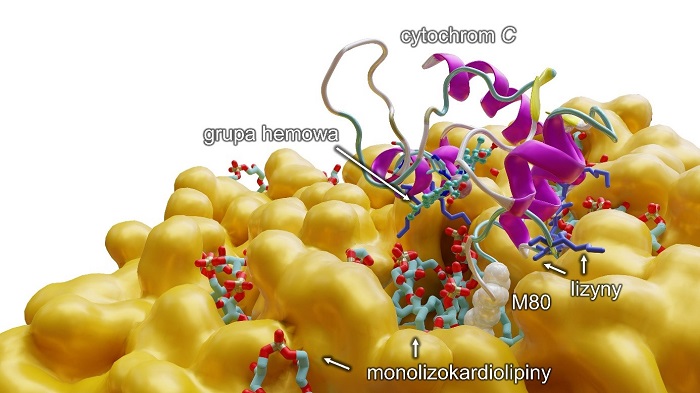
Opis ilustracji: Modelowanie komputerowe ukazujące na poziomie molekularnym oddziaływanie monolizokardiolipiny z cytochromem c, które skutkuje rozerwaniem wiązania między żelazem z grupy hemowej a metioniną 80 (M80) i przejście cytochromu do pięciokoordynacyjnej formy, aktywując przy tym anormalną funkcjonalność białka, czyli zdolność do peroksydacji wielonienasyconych kwasów tłuszczowych (PUFA). Dodatkowo (na niebiesko) przedstawiono lizyny, aminokwasy o dodatnim ładunku, które pozwalają cytochromowi c przyłączyć się do błony lipidowej (na pomarańczowo).
Nauka w Polsce
kol/ bar/
Fundacja PAP zezwala na bezpłatny przedruk artykułów z Serwisu Nauka w Polsce pod warunkiem mailowego poinformowania nas raz w miesiącu o fakcie korzystania z serwisu oraz podania źródła artykułu. W portalach i serwisach internetowych prosimy o zamieszczenie podlinkowanego adresu: Źródło: naukawpolsce.pl, a w czasopismach adnotacji: Źródło: Serwis Nauka w Polsce - naukawpolsce.pl. Powyższe zezwolenie nie dotyczy: informacji z kategorii "Świat" oraz wszelkich fotografii i materiałów wideo.













