Pan tu nie stał - tak można by zatytułować opublikowany w Science Advanced obraz mikroskopowy uzyskany w krakowskich laboratoriach, który zaskoczył wytrawnych biochemików. To może być przełom w zrozumieniu, jak funkcjonują "małe elektrownie" w komórkach roślinnych.
O zaskakującym mechanizmie, który skłonił biologów do wysnucia nowej teorii dotyczącej procesów zachodzących wewnątrz białek, opowiedział PAP prof. dr hab. Artur Osyczka z Wydziału Biochemii, Biofizyki i Biotechnologii Uniwersytetu Jagiellońskiego (UJ).
NAUKOWE SPOSTRZEŻENIE BEZ PRECEDENSU
Gdyby naukowcom udało się rozpracować „małe elektrownie” organizmów, to w bardzo, bardzo odległej przyszłości być może ich następcom uda się naśladować pomysły natury i stworzyć molekularne silniki o wysokiej wydajności. Na razie jednak nauka podstawowa musi w ogóle stworzyć fundament dla takich planów.
Badacze coraz doskonalszymi metodami podglądają naturę i znajdują zupełnie zaskakujące prawidłowości. W tym wypadku dotyczą one układów cząstek w komórce roślinnej, które przekształcają energię świetlną na energię chemiczną w procesie fotosyntezy.
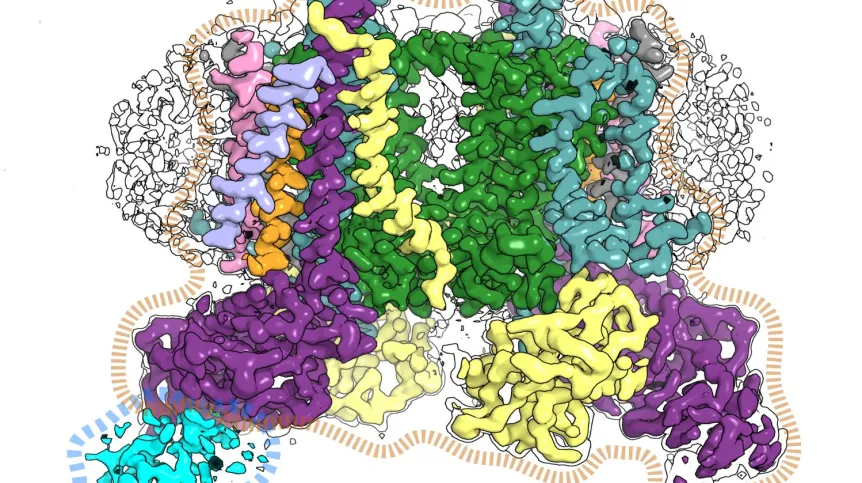
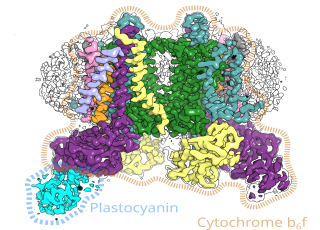
Do przekształcania energii organizmy żywe wykorzystują enzymy. Są to katalizatory, czyli układy które w odpowiedni sposób kierunkują reakcje chemiczne aby zachodziły procesy, takie jak fotosynteza. Naukowcy z UJ wyizolowali jedno z takich białek (cytochrom b6f) i pokazali jego strukturę za pomocą mikroskopii krioelektronowej.
„Obraz bardzo wysokiej jakości odkrył przed nami ciekawe szczegóły. Zobaczyliśmy ułożone w nietypowy sposób substraty, czyli substancje potrzebne do tego, aby enzym zadziałał. Wyglądało, jakby czekały w kolejce aż zostaną poddane reakcji chemicznej. Obraz sugeruje ponadto, że wchodzą one do białka jedną drogą, a wychodzą inną – jak pasażerowie przy odprawie na lotnisku” - opowiada prof. dr hab. Artur Osyczka, współkierujący badaniami wraz z dr. hab. Sebastianem Glattem prowadzącym grupę Maxa Plancka Małopolskiego Centrum Biotechnologii UJ.
Naukowiec wyjaśnia, że uzyskana struktura białka jest odpowiednikiem najwyższej jakości zdjęć wykonanych na zasadzie „stop klatek”. Struktura prezentuje wybrany fragment czasoprzestrzeni, ale bezpośrednio nie pokazuje ruchu cząsteczek. Dlatego hipotezę związaną z ruchem substratu trzeba będzie jeszcze potwierdzić.
„Odkrycie tego oddziaływania rzuca również nowe światło na temat sposobu, w jaki może dochodzić do regulacji procesu fotosyntezy na poziomie cytochromu b6f z udziałem białka TSP9” - wyjaśnia pierwszy autor pracy dr hab. Marcin Sarewicz. Nasza struktura pokazała bowiem, że białko TSP9 wiąże się w specyficznym miejscu do cytochromu b6f, a białko to, choć znane jako czynnik regulatorowy, nie było wcześniej w ogóle rozważane jako potencjalny partner cytochromu b6f.
W ocenie dra hab. Glatta jest to obecnie najdokładniejszy model cytochromu b6f dla roślin wyższych. Ze względu na wyjątkowo wysoką rozdzielczość pozwoli on dokonywać obliczeń kwantowo-mechanicznych. Dalsze badania wyjaśnią fizyko-chemiczne podstawy kluczowych reakcji fotosyntezy katalizowanych przez cytochrom b6f.
PETENCI W KOLEJCE DO OKIENKA
Naukowcy starają się zrozumieć, na czym polega sprawne działanie enzymu, czyli wydajność energetyczna.
„Być może układ działa analogicznie do systemu kolejki. Wyobraźmy sobie załatwianie spraw w urzędzie: mamy okienko z urzędnikiem - tym okienkiem jest centrum katalityczne naszego enzymu. W kolejce ustawiają się ludzie czekający na załatwienie swoich spraw - odpowiednikami petentów są substraty. Do tej pory sądzono, że do +okienka+ prowadzi tylko jedno wejście. Uważano, że substrat, czyli nasz petent, po tym, jak zostanie +obsłużony+, musi się wycofać i wyjść tą samą drogą, którą przyszedł. Mamy jednak podstawy sądzić, że jest inaczej” - mówi prof. Osyczka.
Wzajemne ułożenie cząsteczek substratu sugeruje istnienie kanału umożliwiającego ich jednokierunkowy przepływ. Co ciekawe, zarówno wejście jak i wyjście tego kanału znajduje się w osobnych rejonach białka. W czasie przepływu dochodzi do reakcji katalitycznej - następuje "obsługa petenta". Gdyby dalsze badania potwierdziły obserwacje krakowskich naukowców, byłoby to odkrycie całkowicie nowego sposobu oddziaływania białka z substratem.
JEDNO WEJŚCIE, DRUGIE WYJŚCIE - JAK NA LOTNISKU
Hipoteza krakowskich badaczy zakłada, że „petenci” przechodzą do okienka jak przy odprawie na lotnisku - wchodzą jednym wejściem, a wychodzą drugim. Mikroskop elektronowy Titan Krios G3i w Narodowym Centrum Promieniowania Synchrotronowego SOLARIS pokazał bowiem naukowcom ciąg substratów sugerujący możliwość ich przesuwania się w białku jednym kierunku.
„Ma to sens, zwłaszcza w przypadku, gdyby korytarz dla osób stojących w kolejce do okienka był bardzo wąski (a tak właśnie jest w przypadku kanału w białku): zapewnienie wyjścia z innej strony mogłoby usprawnić proces obsługi petentów przez to, że obsłużony już petent, wychodząc, nie blokowałby dojścia kolejnemu. Dla układu białka oznaczałoby to zwiększenie efektywności jego działania” - porównuje prof. Osyczka.
Koncept biochemików i biologów strukturalnych trzeba będzie jeszcze potwierdzić. Naukowcy badają zarówno mechanizmy przekształcania energii w komórkach roślin, jak i mitochondria, które są odpowiednikiem „elektrowni komórkowych” u zwierząt i ludzi. Ludzkie i zwierzęce układy enzymów również działają z dużą wydajnością, tylko wyjściowym źródłem energii nie jest światło, ale substancje chemiczne.
W przypadku zwierząt znane są struktury badanego przez naukowców białka, ale z kolei te struktury „nie pokazały” do tej pory jeszcze substratu – być może jest on zbyt ruchliwy żeby zarejestrowały go struktury krystalograficzne.
Artykuł źródłowy można znaleźć tutaj.
Projekt był finansowany ze środków przyznanych przez Fundację na rzecz Nauki Polskiej (grant TEAM kierowany przez A. Osyczkę, oraz TEAM TECH Core Facility kierowany przez S. Glatta).
PAP - Nauka w Polsce, Karolina Duszczyk
kol/ agt/
Fundacja PAP zezwala na bezpłatny przedruk artykułów z Serwisu Nauka w Polsce pod warunkiem mailowego poinformowania nas raz w miesiącu o fakcie korzystania z serwisu oraz podania źródła artykułu. W portalach i serwisach internetowych prosimy o zamieszczenie podlinkowanego adresu: Źródło: naukawpolsce.pl, a w czasopismach adnotacji: Źródło: Serwis Nauka w Polsce - naukawpolsce.pl. Powyższe zezwolenie nie dotyczy: informacji z kategorii "Świat" oraz wszelkich fotografii i materiałów wideo.