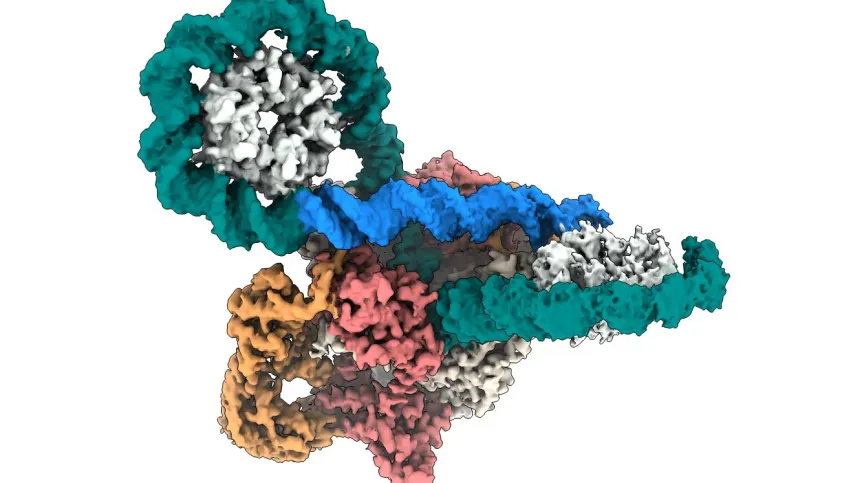
Naukowcy opublikowali na obrazach w niespotykanej dotąd rozdzielczości mechanizm działania gyrazy DNA, kluczowego enzymu dla przetrwania bakterii. To odkrycie otwiera drogę do opracowania antybiotyków skutecznych przeciwko infekcjom opornym na leczenie – oceniają biotechnolodzy z UJ, którzy zbadali enzym korzystając z zaawansowanej mikroskopii krioelektronowej.
Jak poinformowało Małopolskie Centrum Biotechnologii Uniwersytetu Jagiellońskiego, polscy badacze we współpracy z naukowcami z Uniwersytetu w Durham oraz John Innes Centre, dokonali przełomowego odkrycia w badaniach nad gyrazą DNA – kluczowym enzymem bakteryjnym i ważnym celem terapeutycznym dla antybiotyków.
DELIKATNY PROCES MOŻE ZDECYDOWAĆ O ŚMIERCI BAKTERII
Gyraza DNA występuje wyłącznie u bakterii i odgrywa niezbędną rolę w procesie superskręcania DNA, który jest kluczowy dla przetrwania bakterii. Badacze wykorzystali zaawansowane metody mikroskopii krioelektronowej i uchwycili szczegóły mechanizmu działania tego enzymu na poziomie, który – jak podkreślono w informacji prasowej – wcześniej nie był możliwy.
Jak wyjaśniają naukowcy w komunikacie, gyraza DNA działa jak mikroskopijna maszyna molekularna, skręcając i stabilizując DNA bakterii. Proces ten, znany jako superskręcanie, przypomina skręcanie gumki – im bardziej się ją skręca, tym jej struktura staje się bardziej kompaktowa. W przeciwieństwie jednak do gumki, która po uwolnieniu szybko się rozkręca, gyraza stabilizuje skręcone DNA, umożliwiając bakteriom jego wykorzystanie w procesach biologicznych.
Enzym ten układa DNA w pętlę przypominającą ósemkę, następnie precyzyjnie rozcina, skręca i ponownie łączy helisę DNA. Jest to niezwykle delikatny proces – jeśli DNA pozostałoby rozcięte, byłoby to dla bakterii śmiertelne. Antybiotyki, takie jak fluorochinolony, uniemożliwiają ponowne zespolenie rozciętego DNA, co prowadzi do śmierci komórki bakteryjnej. Jednak narastająca oporność bakterii na te leki skłoniła naukowców do podjęcia prób głębszego zrozumienie mechanizmu działania gyrazy.
UCHWYCILI GYRAZĘ W TRAKCIE PRACY
W publikacji prezentującej wyniki tych badań pokazali, jak enzym ten owija DNA wokół rozciągniętych ramion białkowych, nadając mu charakterystyczny kształt ósemki.
„Dokładna struktura białka z transportowanym fragmentem DNA to ogromny krok naprzód w kierunku pełnej charakterystyki mechanizmu katalitycznego gyrazy” – uważa Elizabeth Michalczyk, doktorantka z Małopolskiego Centrum Biotechnologii i pierwsza autorka pracy, cytowana w komunikacie.Obrazy uzyskane w badaniu ukazują enzym jako skoordynowany, wieloelementowy system, w którym każda część porusza się w precyzyjnej sekwencji i umożliwia proces superskręcania DNA.
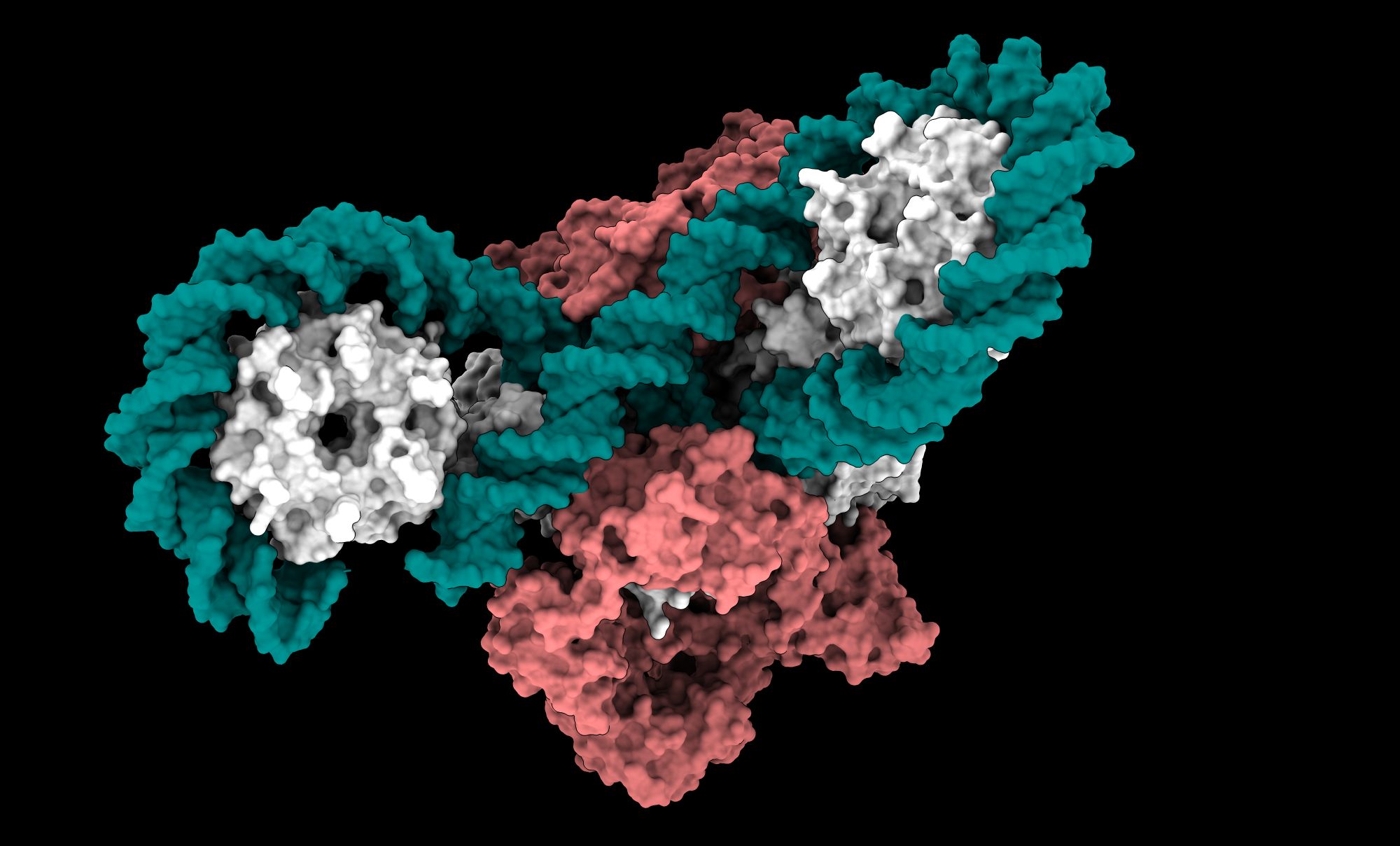
Współautor pracy, prof. Jonathan Heddle z Uniwersytetu w Durham, również cytowany w informacji prasowej podkreślił, że dokładna pozycja i kolejność ruchu złożonych części enzymu podczas procesu superskręcania DNA nie wyglądają tak, jak dotychczas sądzili naukowcy. Dlatego wyniki badań mogą wpłynąć na sposób projektowania nowych inhibitorów i opracowanie nowych antybiotyków, które będą działać na gyrazę w bardziej precyzyjny sposób i ominą mechanizmy oporności.
Zespół planuje dalsze badania m.in. uchwycenie dodatkowych etapów działania enzymu i stworzenie molekularnego „filmu” przedstawiającego, jak działa gyraza. Takie podejście może pomóc w opracowaniu kolejnej generacji antybiotyków, które będą bardziej precyzyjne i skuteczne w zwalczaniu infekcji bakteryjnych.
Dane zebrano przy użyciu mikroskopu elektronowego Titan Krios G3i znajdującego się w Narodowym Centrum Promieniowania Synchrotronowego SOLARIS. Badania w MCB były finansowane z grantu NCN OPUS-20.
Nauka w Polsce
kol/ agt/
Fundacja PAP zezwala na bezpłatny przedruk artykułów z Serwisu Nauka w Polsce pod warunkiem mailowego poinformowania nas raz w miesiącu o fakcie korzystania z serwisu oraz podania źródła artykułu. W portalach i serwisach internetowych prosimy o zamieszczenie podlinkowanego adresu: Źródło: naukawpolsce.pl, a w czasopismach adnotacji: Źródło: Serwis Nauka w Polsce - naukawpolsce.pl. Powyższe zezwolenie nie dotyczy: informacji z kategorii "Świat" oraz wszelkich fotografii i materiałów wideo.













